L’ACTOR
La verola de mico que està circulant en països no endèmics aquest 2022 no és la “mateixa” que es va descriure per primer cop en 1958, a Copenhaguen, en una colònia de micos cynomolgus destinada a recerca.
Per començar, fins i tot el nom és incorrecte. Estem parlant de la verola de mico , quan els primats, com nosaltres, no som el reservori. Com a exemple de la poca recerca feta (i de la dificultat de la mateixa) no es coneix, del cert, el reservori del virus de la verola de mico. Virus zoonotic, sí, que tindria com a font original alguna espècie de rosegador (esquirols, gata de Gàmbia, etc.) de les selves tropicals de l’Africa Central o de l’Oest, i que és capaç d’infectar-nos a nosaltres però també a gossos de les praderies, conills, i animals de laboratori.
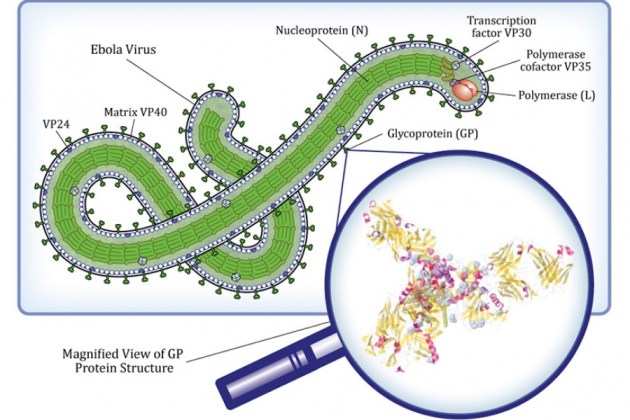
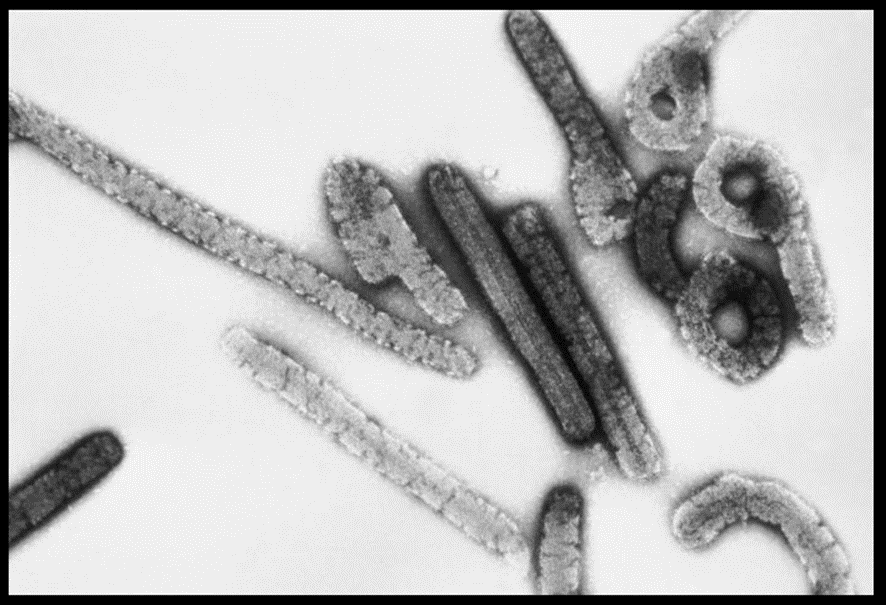
Hi ha més d’una verola de mico, si donem una ullada als seus efectes. Podem distingir dos grups o clades tradicionals (fins el 2022). El clade 1 és endèmic (per tant vol dir que es manté sostingudament en circulació) a l’Africa Central, i abasta RDC, República Centrafricana, Gabon, Camerun i Sudan del Sud. La taxa de mortalitat dels infectats per aquest clade es troba entre el 6 i el 15% (una taxa gens menystenible). El clade 2 és també endèmic a l’Oest d’Àfrica (Nigèria, Libèria, Sierra Lleona, Costa d’Ivori i Camerun) i la taxa de mortalitat és molt més baixa, de l’ordre del 0,1%. La diferència entre els dos clades és minsa, des del punt de vista estructural i de composició. En els dos casos són partícules víriques grans de l’ordre de 200-250 nm, i indistingibles a simple vista (de fet, cal microscòpia electrònica) entre ells o amb el virus de la verola humana, o el virus Vaccinia. En els dos casos tenen un genoma gran, de l’ordre de 200 kilobases (kb); en comparació, recordin que SARSCoV2 té un genoma de 30.000 bases (30 kb). Codifica per gairebé 200 proteïnes; doncs bé, només un 0,5% del genoma mostra diferències entre els dos clades però són diferencies que afecten a gens de virulència (com, per exemple, un gen que codifica per a una proteïna que evita que s’activi la via del complement en l’humà, que es troba al Clade 1 però està absent al Clade 2).
El tercer clade descrit és l’actual, que derivaria del clade 2, i que seria l’únic considerat pandèmic (s’ha estès a més de 100 països amb més de 78.000 infectats hores d’ara). I sí, la mortalitat és manté entorn del 0,1%. Pensem que podria haver passat si el clade que hagués sortit de l’ampolla (la seva àrea geogràfica clàssica) hagués estat el clade 1 o una derivació del mateix.
L’OBRA, REPRESENTACIONS
El virus de la verola de mico repetia la mateixa obra des de fa molts anys amb un discret èxit de públic, infectats. Descrit inicialment en primats el 1958, el primer cas en humans descrit for el 1970, a la República Democràtica del Congo, en un infant de 9 mesos, que es recuperà per morir poc després de xarampió. Casos en nens, 1970 i 1971 en països del Africa de l’Oest, no vaccinats front la verola humana. Petits brots en viles remotes principalment a RDC fins el 2003. El 2003 va haver la primera “gira internacional” amb un brot que afectà a una setantena de persones als USA, principalment a Texas, i transmesa per gossos de les praderies (un animal de companyia) que al seu cop l’havien adquirit de rates de Gàmbia importades amb les que havien compartir allotjament (botigues d’animals). Des d’aleshores, representacions continuades però amb baix impacte als països endèmics i alguna sortida molt puntual en forma de casos importats (persones que viatjaven a països endèmics i mostraven els símptomes un cop retornats al país d’origen, com a Gran Bretanya, USA, Singapur, Israel). Tanmateix es detectava un increment lent però constant dels casos amb els anys (i s’assignava també a una esvaïment gradual de la protecció conferida per la vacunació de la verola, que es va deixar d’administrar l’any 1980); a RDC entre 1986 i 2006 el casos es multiplicaren per 20; a Nigèria aquest increment es va veure també. El primer assaig de la nova obra a estrenar el 2022 va tenir lloc a Nigèria el 2017 (i no vam prestar gaire, gens, atenció). Abastà un mínim de 122 casos confirmats o probables i una mortalitat no negligible, del 6%, amb una mitjana d’edat dels casos de 29 anys, personal sanitari afectat i evidències clares de transmissió entre humans (no gaires casos es podien explicar per salt zoonòtic). Circulació majoritàriament urbana, no rural i també indicis clars de transmissió sexual (ulceres genitals en homes, majoritàriament, alguns dels quals patien de sífilis i VIH, veure https://journals.sagepub.com/doi/full/10.1177/09564624221119335) que fins aquell moment no s’havien descrit.
Arriba «l’èxit».
Ben iniciat el 2022 (i amb dubtes si no s’hauria haver iniciat abans) esclata l’èxit, si bé nomes en un sector de la població. Verola de mico s’estén en una progressió més aritmètica que geomètrica en un centenar de països que mai l’havien tinguda, assolint un total de 78.000 casos amb menys d’un centenar de morts associades (dades de finals novembre 2022). Els països més impactats en aquesta gira són USA, Brasil i Espanya (fins a la data), però l’èxit (pel virus) s’ha circumscrit a un sector de la població, homes que tenen sexe (molt freqüent) amb altres homes, o MSM (al voltant del 95% de casos dels que es coneix l’orientació sexual), i ha tingut molt poc impacte en homes heterosexuals, dones i nens. Encara que s’assumeixen múltiples introduccions, alguns events multitudinaris que aplegaren milers de MSM ajudaren a la diàspora viral.
L’OBRA, ARGUMENT.
L’argument de tota infecció vírica té tres fases equivalents a inici, trama i desenllaç. Aquí podem parlar de la fase d’incubació, la fase prodòmica, i la fase eruptiva amb la manifestació de símptomes clars i la resolució final. En el primer llibret (fins el 2022) la fase d’incubació durava una mitjana de 13 dies, a la que seguia una fase prodromal de 1 a 4 dies (treien el cap símptomes inespecífic com febre alta, mal de cap, fatiga, i freqüentment linfoadenopaties), i aquesta donava pas a la fase eruptiva, amb aparició de lesions a la pell en representació centrifuga (molt freqüent a les extremitats), i que passaven per diferent etapes; màcules, pàpules, vesícules, pústules i descamació, normalment en sincronia (totes els lesions estaven en la mateixa etapa). Aquest argument generava força més impacte en infants i dones gestants que no en altres segments de la població. En funció del clade afectat la mortalitat era molt baixa (clade 1) o significativa (clade 2).
Canvis al llibret del 2022
Aparentment s’escurça el període d’incubació, que quedaria tot just per sobre dies 9 dies (dades de Gran Bretanya). En prou infectats la fase prodròmica sembla no existir, o està molt poc marcada, i passen d’una absoluta normalitat a presentar erupcions sense el pre-avís de símptomes inespecífics com febre o cansament. A més el nombre de lesions dèrmiques és molt variable (de unes poques a centenars), i evolucionen de forma asincrònica, i finalment s’acumulen, molt específicament, en zona genital, anal i perianal o en mucosa bucal (en un brot a Espanya, més del 40% dels afectats mostraven lesions en la regió oral o perioral). El que s’ha mantingut invariable és l’afectació hospitalària (baixa) i la mortalitat (de l’ordre del 0,1% o inferior), ja que el virus de gira deriva del clade 1. Hi ha hagut dos casos d’infectats joves, immunocompetents, que moriren per encefalitis però encara cal esbrinar aquest entrellat.
REBUDA DE L’OBRA.
És evident que aquesta darrera versió s’ha rebut amb molta crítica. S’hauria de preguntar un, tanmateix, perquè aquesta crítica no es feu a les anteriors representacions; certament aplegaren a menys públic però anunciaven el que vindria. Davant d’obres d’aquesta mena nomes hi ha dues respostes, els tractaments pre-exposició (NO anar a l’obra, els vaccins) o el tractaments post-exposició (llençar tomàquets a l’actor, antivirals en aquest cas). Anem per la primera resposta.
Vaccinació (no anar a l’obra). Els vaccins actualment disponibles serien el ACAM2000 (de Emergent BioSolutions), vaccí de segona generació i el MVA-BN (comercialitzat com IMVANEX o JYNNEOS), que seria un vaccí de tercera generació. El primer està aprovat al USA per a ser emprat abans o després de l’exposició a verola de mico; efectiu però associat a un increment de risc de complicacions cardíaques i encefalitis ja que és un vaccí atenuat replicatiu (que mostrava poca neuro-virulència en model animal i que provenia d’un vaccí de 1a generació però que SÍ replica en el cos del vacunat). No seria administrable a dones gestants, gent amb problemes cardíacs, o de pell, i immunocompromesos. El vaccí MVA (Modified Vaccinia Ankara) de Bavarian Nordic (BN) és un vaccí atenuat NO replicatiu, aprovat per fer front a verola a USA i Europa, també als USA (2019) per verola de mico i ara, aquest 2022 també a Europa. Aquest vaccí NO replicatiu és administrable a persones amb problemes de immunodepressió. MVA-BN també s’està prescrivint com a tractament UN COP VISTA l’obra, per reduir els efectes de la infecció, amb un màxim de 4 dies post-exposició, i en una estratègia en anella per protegir als contactes de l’infectat. L’escassedat d’aquest segon vaccí, l’únic administrable “universalment”, que precisa de dues dosis subcutànies separades per 28 dies ha fet adoptar una estratègia de inoculació intradermal fent servir només 1/5 part de la dosi emprada a l’administració subcutània i amb una única dosi/administració, per majors de 18 anys. És una “estratègia de guerra” perquè es basa en assumpcions lògiques però no provades en cap assagi clínic específic.
Llençar verdures a l’actor, fins sepultar-lo. Dissortadament no tenim masses verdures, nomes tomàquets i enciams, i nomes els tomàquets semblen efectius. El tecovirimat, aprovat a USA i Europa, és un antiviral que inhibeix una proteïna, la p37, bloquejant la transmissió cèl·lula a cèl·lula del virus. Protegeix, amb una alta probabilitat de la mort, en comparació amb el placebo segons assajos clínics, i probablement també reduiria la duració de la excreció viral i els símptomes de la infecció. El brincidofovir està només autoritzat als USA, inhibeix l’ADN polimerasa, però no hi ha masses assaigs clínics, no amb primats no humans. Però té efectes tòxics a nivell de fetge i gastrointestinals, i no és una primera solució. La resta de tractaments (gamma globulines de plasma purificat de persones vaccinades, immunoglobulines de Vaccinia, anàlegs del tecovirimat, anticossos monoclonals, etc.) o estan massa “verds” o no són massa efectius o no estan autoritzats per al seu ús amb verola de mico.
EPÍLEG
I amb això arribem al final. Altre cop una epidèmia que ens recorda que la emergència viral és un fenomen permanent i, encara que ens irriti, amb els mitjans actuals, impredible pel que fa a natura, localitzacions i magnituds. Una infecció localitzada en una zona concreta, a la que no es destinen recursos ni coneixements salta a zones no endèmiques, canviant les seves manifestacions i la població diana. Que la immunitat front un virus relacionat, com és el cas de la verola, estigui en declivi continuat al Mon, ja que es va deixar de vaccinar sobre el 1980, no ajuda, tampoc. Les contramesures ja són sabudes; millor vigilància, detecció i assistència als primers casos, desenvolupament de nous tractaments pre- i post-exposició i administració ràpida dels mateixos.
Però aquesta, aquesta és tota una altra història.








Comentarios recientes