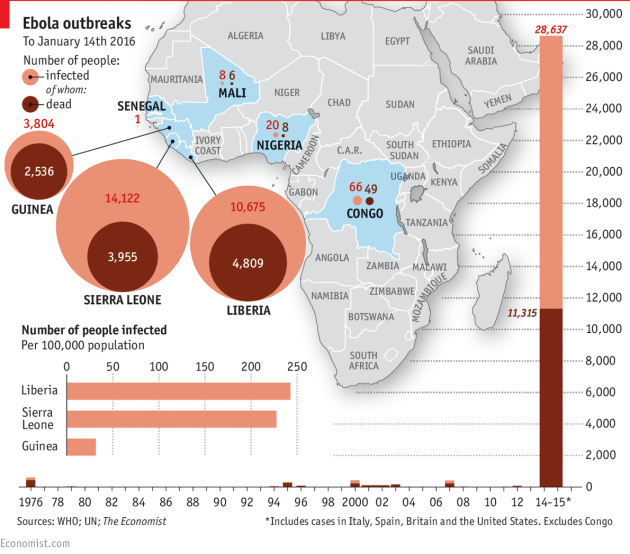
Estem a tocar (menys de dos mesos) del segon aniversari del cas índex d’Ebola (el primer infectat) que ha colpejat Sierra Lleona, Libèria i Guinea i Libèria. Amb la ultima informació disponible, del 14 d’octubre, 13.982, 10.672 i 3.800 casos amb 3.955, 4.808 i 2.534 morts, respectivament. Això dona una taxa de mortalitat oficial global del 40%, amb fortes variacions entre països. Fem un recorregut no exhaustiu per algunes lliçons que se’n deriven.
Les malalties, els patògens, no coneixen fronteres. Aquesta dita no és sols aplicable entre aquests tres països, de fet el cas índex es donà en un vèrtex fronterer entre els tres països si no que Ebola ha tacat amb casos Itàlia, Mali, Nigèria, Senegal, Espanya, Gran Bretanya i EEUU i amb morts Nigèria, Mali i EEUU, segons l’Organització Mundial de la Salut (OMS).
Els essers humans ajudem molt si forcem la nostra presència en habitats nous, o si generem condicions (guerres, desplaçaments de refugiats, desforestació) que afavoreixen el salt dels patògens del component zoonotic a l’humà. Recordem però que som animals i que com a tals també formem part d’aquest “compartiment”. Si deixem de fer-ho, aquestes intrusions zoonotiques veuran caure la seva freqüència.
No tenim encara mecanismes d’acció ràpida, executius. Un estudi epidemiològic retrospectiu fet per la mateixa OMS indica que el cas índex fou un nen de 18 mesos, vivint a Meliandou, Guinea (a la vora de Gueckedou, a menys de 10 km de la frontera amb Libèria i uns 30 km de la frontera amb Sierra lleona), que començà a desenvolupar una simptomatologia de febre, vòmits i femtes fosques (excrement amb sang, possible indicatiu d’hemorràgia interna) el 26 de desembre i morí dos dies després. Des d’el dia 28 de desembre fins la primera alerta oficial, emesa pel Ministeri de Salut de Guinea, en data 13 de Març, passaren 75 dies. Aquesta alerta, a més informava de una malaltia desconeguda, ja que les morts de familiars, veïns propers, personal sanitari que atengueren aquestos, inclosos sanadors tradicionals, s’havien lligat a una malaltia bacteriana. Recordem que el còlera es una malaltia molt freqüent per aquelles contrades. L’OMS, amb Metges sense Fronteres (MSF), i el Ministeri trobaren noves pistes epidemiològiques que portaren a identificar Gueckedou com l’epicentre de transmissió. Guinea te forts lligams amb França i mostres de morts i malalts s’enviaren a l’Institut Pasteur que conclogué el 21 de març que es detectava un filovirus, i el dia després que aquest filovirus era l’Ebola Zaire. Únicament aleshores, 23 de març, OMS anuncià públicament el brot, quan ja s’havien comptabilitzar 49 casos i 29 morts. Perquè? La presentació clínica de Ébola és prou enganyosa; les cinematogràfiques i impactants hemorràgies que es poden donar al tram final de la infecció no són la norma general i la infecció que inicialment té els símptomes inespecífics d’una grip pot arribar a confondre’s amb altres febres hemorràgiques que són típiques de la regió, com la febre de Lassa. Com les simptomatologies de moltes infeccions són prou inespecífiques en el seu començament és possible que aquesta situació es torni a repetir. El que no s’hauria de torna a repetir és la lentitud, descoordinació, en la resposta posterior, un cop se sap quin és l’agent causal.
Vacunes. No és cert que no hi hagués estudis per desenvolupar vacunes contra l’Ebola. El que no hi havia era una gran necessitat (recordem que els brots han estat dispersos i autolimitants) i que per provar l’eficàcia d’una vacuna calen…malalts. Aquest brot ha permès que desenvolupaments, fets en els darrers anys amb silenci, que necessitaven una ultima empenta trobessin un fast-track, una via ràpida per ser aprovats i provats en condicions de camp. Us sonaran les vacunes VS-EBOV (NewLink Genetics and Merck vaccines) i la ChAd3-ZEBOV, desenvolupada per GlaxoSmithKline, que s’han administrat ja a Àfrica, i que reberen en els seus inicis fortes injeccions de diners públics, de Canada i Estats Units respectivament. Doncs bé, la primera es va patentar el 2003 i les eines per fer la segona es coneixen des de fa una dècada. Però hi ha un mínim de 6 vacunes en proves: la Ad26-EBOV & MVA-EBOV de Johnson&Johnson y Bavarian Nordic; la Novavax; un candidat vacunal xinés; un altre de rus, fent servir virus de la grip recombinant; una altra vacuna basada en ADN; un prototipus vacunal fent servir virus de la ràbia recombinant, etc.
La mida d’un brot importa. Els altres brots d’Ebola han abastat un baix nombre d’afectats (318 a Zaire en 1976; 315 a República Democràtica del Congo (RDC) en 1995; 425 a Uganda el 200-2001; 149 a Uganda 2007 i 264 a RDC al 2007 també) amb taxes de mortalitat per sobre del 50% (llevat d’Uganda 2007, que fou del 25%). Els que sobrevisqueren foren quantitativament pocs perquè els afectats tampoc eren molt nombrosos. Per una banda no se’ls feu un gran seguiment però per altre representaven probablement un sobrevivent típic. Únicament en un brot amb milers de sobrevivents hi ha prou mida de mostra (individus) perquè treguin el nas fenòmens “estranys”: els extrems d’una distribució normal: excrecions víriques de llarga durada; acantonaments vírics detectables; efectes secundaris no descrits, etc. Això ajudarà sens dubte a conèixer més sobre la infecció viral i les seves conseqüències però també donarà lloc a titulars que, no mesurats, poden ser alarmistes.
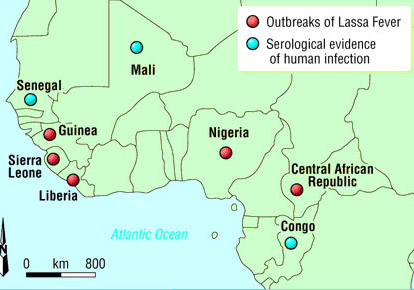
La brillantor enlluernadora d’aquest brot no ha de fer-nos oblidar les altres malalties que encara es donen als països afectats. Sanitàriament, l’atenció mostrada contra l’Ebola ha reduït o deixat en segon terme programes de vacunació indispensables en aquells països com aquells front xarampió, tos ferina o varicel·la, la qual cosa fa preveure futurs brots d’aquestes malalties. El còlera continua present (brot 2012); s’han descrit casos de poliomelitis paralitzant aquest 2015 (procedents de la soca vacunal) i la febre groga (amb vacuna atenuada disponible) i la malària són endèmiques. Alguns mapes de situació (no del tot actualitzats) és mostren a continuació.



En acabat, aquest brot ha fet que tres països africans siguin encara més pobres. L’Ebola ha davallat qualsevol mena de turisme durant molts mesos, ha interromput i generat desconfiança en els intercanvis comercials interns, ha amenaçat la seguretat alimentària, ha frenat la inversió estrangera, ha desballestat els sistemes sanitaris dels països afectats. Els ingressos familiars han caigut, un 12% de mitjana a Guinea…un 35% a Libèria. El producte interior brut (PIB) ha passat a Libèria d’un increment esperat del 8,9 al 0,7 en el darrer any per l’impacte de l’Ebola; a Sierra Lleona d’un esperat 11,3% a únicament un 4%; valors equivalents per Guinea. Un panorama molt descoratjador.
Honorem al personal sanitari. Allà on cerqueu veureu que uns dels principals damnificats en aquesta epidèmia ha estat el personal sanitari local (metges/esses, infermers/eres), la primera barrera de defensa; centenars d’ells han resultats infectats i centenars d’ells han mort, fent encara més difícil el tractament dels nous malalts, sobre tot en el primers mesos d’infecció no diagnosticada i en les puntes del brot, amb desenes i desenes d’infectats setmanals. Una dada; a Libèria, una de cada 1000 persones ha mort degut a l’Ebola; al mateix país, 8 de cada 100 sanitaris han mort pel mateix motiu. L’escenari és semblant als altres països.
No assenyalem. L’Ebola és una malaltia infecciosa que té efectes “biològics” però també efectes socials que no han de ser menystinguts i que es fan forts, s’intensifiquen, davant la manca d’informació o, directament, la desinformació. Així, molts d’aquests orfes han estat repudiats pels seus familiars per por de ser contagiats, encara que estiguessin sans. Ara, correm el mateix perill amb tots els homes supervivents i la detecció del virus al seu semen. I amb tots els supervivents sense distinció de sexe si no se’ls fa un seguiment sanitari i, si cal psicològic.
En una epidèmia d’aquestes característiques no es pot dir mai, en cap país amb medecina i sistemes sanitaris avançats que s’està prou preparat. Per un cas, per deu casos, per cinquanta casos? Potser. Per desenes de casos setmanals, definitivament, no. Ni Catalunya, ni Espanya, ni la Unió Europea.

I desena i última. Som una peça més del trencaclosques de la vida a la Terra. Som contingents, lectors i lectores, i res del que passa o és al món, patògens inclosos, ens és aliè.
Però aquesta, aquesta és una altra historia.




















Comentarios recientes