Molt hem parlat en aquest blog sobre el virus Ebola i les seves conseqüències, però encara no havia fet cap entrada explicant com actua el virus dins el nostre cos. Encara que no soc immunòleg, ni patòleg, anem a solucionar aquest mancança.

Els filovirus (Ebola i Marburg) tenen un efecte directe infectant cèl•lules de la primera línia de defensa immunitària (cèl•lules dendrítiques i macròfags) i alliberant una progènie que pot continuar infectant aquestes però també altres tipus cel•lulars, i per tant es dissemina pel cos.
Ja sabem tots que el virus Ebola entra al cos a traves de les membranes mucoses, ferides a la pell o per via parenteral (una punxada amb un objecte infectat). No és aerògen. Aquest virus té un tropisme (una capacitat de entrada en cèl•lules a les que veu com afins) molt ampli, pot infectar molt tipus cel•lulars i això explica que pugui conduir a una fallada sistèmica de l’organisme. És capaç d’infectar monòcits, macròfags, cèl•lules dendrítiques, cèl•lules endotelials, fibroblasts, hepatòcits, cèl•lules epitelials…
Independentment de la via d’entrada, els macròfags i les cèl•lules dendrítiques són probablement les primeres cèl•lules infectades. El virus Ebola replica bé en aquestes cèl•lules sentinelles, causant la seva mort i alliberant un gran nombre de virus al fluid extracel•lular. Els virus poden arribar als limfonodes, on fan més rondes de replicació i posterior disseminació a més cèl•lules dendrítiques i macròfags fixos o circulants a fetge, melsa, timus i altres òrgans limfoides.
El virus actua de forma directa sobre macròfags i cèl•lules dendrítiques, que son les cèl•lules que inicien la resposta adaptativa. Aquestes cèl•lules en condicions normals processen els antígens i els presenten, els assenyalen als limfòcits perquè aquests fabriquin anticossos envers aquells. Dit altrament, les cèl•lules dendrítiques capten un element aliè, un virus, el processen, és a dir, el desmunten en peces, i exposen aquestes peces al seu exterior, a la seva membrana perquè els limfòcits sàpiguen envers què han de produir els anticossos. Pel cas dels filovirus, les cèl•lules dendrítiques son incapaces de presentar eficientment i “on time” aquests antígens i per tant, no es produeixen anticossos.
Tot aquesta ràpida expansió és afavorida per què el propi virus indueix supressió de les respostes mediades per interferó tipus I. Per interferons cal entendre un conjunt de proteïnes que alerten els mecanismes de defensa propis del cos. Una de les vies emprades ha estat descrita fa poc, i és la molècula del virus anomenada VP24, que bloqueja el canal que empra un missatger, anomenat STAT1, per entrar al nucli de la cèl•lula i avisar i posar en marxa la bateria de gens i proteïnes que han de respondre a la infecció (Xu… and Amarasinghe, 2014). Tanmateix, blocar aquest via no garanteix que el virus no tingui altres vies no descrites per fer el mateix efecte. Amb la progressió de la malaltia, hepatòcits, cèl•lules adrenals, fibroblasts i altres són infectades i es fa extensiva la necrosi.
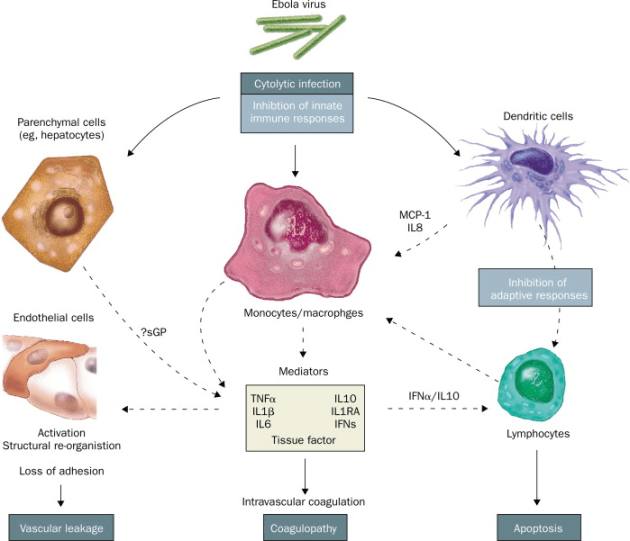
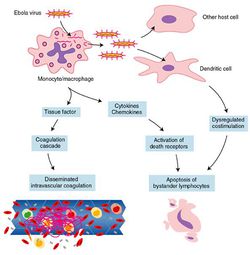
Els filovirus també indueixen una síndrome inflamatòria mitjançant l’alliberament de citoquines, quimioquines i altres mediadors pro-inflamatoris des d’els macròfags infectats.
Els macròfags infectats produeixen factor necròtic tumoral alfa (TNF-alfa), interleuquina-1beta, interleuquina 6, i òxid nítric (NO) entre altres molècules. Els productes alliberats des de les cèl•lules necròtiques també estimulen la producció d’aquestes molècules, en un cercle viciós. Per tant és la resposta del organisme infectat, més que el propi efecte tòxic del virus el que és responsable de la febre, vasodilatació, increment de la permeabilitat vascular, hipotensió i entrada en shock.
Els defectes de coagulació també són un efecte indirecte. Els macròfags infectats pel virus sintetitzen unes molècules de la superfície cel•lular, TF (tissue factor), que disparen, activen la via de coagulació extrínseca. Les citoquines pro-inflamatòries de les que hem parlat abans també indueixen la producció de TF pels macròfags, fins i tot, els no infectats. Per tant per dos vies diferents i simultànies tenim un ràpid desenvolupament i alta severitat de quadre de coagulopaties en infectats per filovirus.
Els problemes de coagulació s’aguditzen perquè el virus també actua sobre la proteïna C i sobre les plaquetes, i més endavant la progressió de la malaltia i la seva afectació al fetge pot ajudar a una caiguda de certs factors de coagulació.
La causa de les hemorràgies obeeix a la infecció per part dels filovirus de les cèl•lules endotelials que són les que recobreixen la part interior dels vasos sanguinis, la qual cosa facilita la sortida de la sang cap els teixits. En això Ebola i Marburg tenen manifestacions clíniques semblants. De fet les hemorràgies no son més que un dels símptomes finals i tampoc son tant freqüents; aquesta és la raó que als països afectats es parli mes de malaltia del virus Ebola que no febre hemorràgica d’Ebola.
La sortida de la sang dels seus conductes cap els teixits fa que el volum “real” de sang en circulació minvi i que cèl•lules i òrgans no rebin prou oxigen ni nutrients per funcionar adequadament. També hi ha un canvi en la composició electrolítica de la sang, el seu contingut en sals; aquesta és la raó per la que una de les mesures de suport és mantenir al pacient hidratat i controlar el seu nivell d’electròlits.
El virus malmet la resposta immune adaptativa actuant sobre les cèl•lules dendrítiques (ja comentat) i fomentant l’apoptosi (una mort cel•lular programada) dels limfòcits, la qual cosa implica una gran reducció del seu nombre, probablement induïda pels factors inflamatoris esmentats més amunt. En qualsevol cas aquest efecte no ha de ser del 100% però encara que al final sí hi hagi una proliferació de limfòcits específics anti-filovirus pot ser que aquesta arribi massa tard per evitar el final fatal.
En resum, els filovirus (Ebola i Marburg) tenen un efecte directe infectant cèl•lules de la primera línia de defensa immunitària (cèl•lules dendrítiques i macròfags) i alliberant una progènie que pot continuar infectant aquests però també altres tipus cel•lulars, i per tant es dissemina pel cos. Però, probablement més important que aquest efecte, enganyen i destaroten el sistema immune aturant o retardant la generació d’anticossos específics al forçar un augment desmesurat de factors inflamatoris que deixen KO els limfòcits. Tot això en un escenari de leucopènia, trombocitopènia, desordres a la coagulació i problemes renals. Eliminat o minvada aquesta resposta immune el camp, el nostre cos, està lliure i disponible.
Tanmateix, la genètica particular de cadascun i el seu estat fisiològic previ juguen un paper que no podem acabar de valorar.
Però aquesta, aquesta és una altra història.
Xu, W., Edwards, M.R., … and Amarasinghe G.K. 2014. Cell Host and Microbe. 16:187-200.
http://www.cell.com/cell-host-microbe/abstract/S1931-3128%2814%2900263-7
Per més sobre Ebola també teniu aquest enllaç al Que,qui,com on intervinc…
http://blogs.tv3.cat/quequicom.php?itemid=54682








Comentarios recientes